Unterschied zwischen aliphatischen und aromatischen Aminen | Aliphatische gegen aromatische Amine
Aliphatisch gegen aromatische Amine
Der beste und bedeutendste Unterschied zwischen aliphatischen und aromatischen Aminen ist der strukturelle Unterschied zwischen den beiden Verbindungen. Aliphatische Amine sind die Aminverbindungen, in denen Stickstoff nur an Alkylgruppen gebunden ist, und aromatische Amine sind die Aminverbindungen, in denen Stickstoff an mindestens eine der Arylgruppen gebunden ist. Dieser strukturelle Unterschied führt zu allen anderen Unterschieden in ihren Eigenschaften wie Reaktivität, Säuregehalt und Stabilität.
Was sind aliphatische Amine?
In aliphatischen Aminen ist Stickstoff nur an Alkylgruppen und Wasserstoffatome gebunden. Die Anzahl der Alkylgruppen variiert von eins bis drei. Je nach Anzahl der angehängten Alkylgruppen werden sie " primäre Amine (nur eine Alkylgruppe -1 o ), sekundäre Amine Alkylgruppen - 2 0 ) und " tertiäre Amine (drei Alkylgruppen - 3 0 ).
Alle aliphatischen Amine sind schwache Basen wie Ammoniak, aber sie sind etwas stärkere Basen als Ammoniak. Sie alle haben fast die gleiche Basisstärke von Pkb = 3-4. Die Basizität erhöht sich, wenn die Wasserstoffgruppen am Stickstoffatom durch Alkylgruppen ersetzt werden. Tertiäre Amine sind basischer als primäre und sekundäre Amine.
Wenn Stickstoff eines der Atome in einem Ring ist, heißen sie heterocyclische Amine . Piperidin und Pyrollidin sind zwei Beispiele für aliphatische heterocyclische Amine.
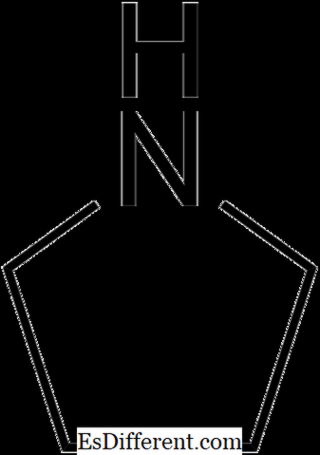
Pyrollidine
Was sind aromatische Amine?
In aromatischen Aminen ist Stickstoff direkt an mindestens einen Benzolring gebunden. Abhängig von der Anzahl der an das Stickstoffatom gebundenen Gruppen werden sie als "primäre", "sekundäre" und "tertiäre" Amine kategorisiert. " Arylamine " ist ein anderer Name für aromatische Amine. Ähnlich wie aliphatische Amine können primäre und sekundäre aromatische Amine intermolekulare Wasserstoffbrückenbindungen bilden. Daher sind Siedepunkte von primären und sekundären Aminen relativ höher als die tertiären Amine.
Es gibt heterocyclische aromatische Amine ; Pyrrol und Pyrydine sind zwei Beispiele dafür.

Pyrydine
Was ist der Unterschied zwischen aliphatischen und aromatischen Aminen?
• Struktur:
• Alkylamine enthalten keine Benzolringe, die direkt an ein Stickstoffatom gebunden sind.
• In aromatischen Aminen ist jedoch mindestens ein Benzolring direkt an das Stickstoffatom gebunden.
• Aliphatische Amine können aromatische Ringe haben, solange Stickstoff direkt an ein Kohlenstoffatom gebunden ist.
• Basizität:
• Aliphatische Amine sind stärkere Basen als aromatische Amine. Dies ist im Wesentlichen auf die Stabilität des nach der Ionisation entstehenden Kations zurückzuführen. Mit anderen Worten, Alkylammoniumionen sind stabiler als Arylammoniumionen. Weil Alkylgruppen Elektronen freisetzende Gruppen sind und daher die positive Ladung am Stickstoffatom teilweise delokalisieren.

• Aliphatische heterocyclische Amine sind auch stärkere Basen als aromatische heterocyclische Amine.
Beispiele
Beispiele für aliphatische heterocyclische Amine sind Piperidin und Pyrollidin.
Beispiele für heterocyclische aromatische Amine sind Pyrrol und Pyrydin.
Bilder mit freundlicher Genehmigung: Pyrollidine und Pyridin über Wikicommons (Public Domain)


