Unterschied zwischen Alpha Helix und Beta Pleated Sheet | Alpha Helix und Beta Pleated Sheet
Schlüsselunterschiede - Alpha-Helix vs Beta-Faltblatt
Alpha-Helices und beta-Faltblätter sind die beiden am häufigsten gefundenen Sekundärstrukturen in einer Polypeptidkette. Diese zwei strukturellen Komponenten sind die ersten Hauptschritte beim Falten einer Polypeptidkette. Die Schlüsseldifferenz zwischen Alpha Helix und Beta Pleated Sheet ist in ihrer Struktur ; Sie haben zwei verschiedene Formen für einen bestimmten Job.
Was ist Alpha Helix?
Eine Alpha-Helix ist eine rechtshändige Spule von Aminosäureresten an einer Polypeptidkette. Der Bereich der Aminosäurereste kann von 4 bis 40 Resten variieren. Die zwischen dem Sauerstoff der C = O-Gruppe an der oberen Spule und dem Wasserstoff der N-H-Gruppe der unteren Spule gebildeten Wasserstoffbrücken tragen dazu bei, die Spule zusammenzuhalten. Auf jede der vier Aminosäurereste in der Kette wird auf die obige Weise eine Wasserstoffbrücke gebildet. Dieses einheitliche Muster gibt ihm bestimmte Merkmale wie die Dicke der Spule und diktiert die Länge jeder vollständigen Umdrehung entlang der Helixachse. Die Stabilität der Alpha-Helix-Struktur hängt von verschiedenen Faktoren ab.

O-Atome in Rot, N-Atome in Blau und Wasserstoffbrücken als grüne gestrichelte Linien
Was ist Beta-Faltblatt?
Beta-Faltblatt, auch Beta-Blatt genannt, gilt als zweite Form der Sekundärstruktur in Proteinen. Es enthält Beta-Stränge, die durch ein Minimum von zwei oder drei Backbone-Wasserstoffbrücken lateral verbunden sind, um eine verdrehte, gefaltete Folie zu bilden, wie in der Abbildung gezeigt. Ein Beta-Strang ist eine Strecke der Polypeptidkette; seine Länge ist im Allgemeinen gleich 3 bis 10 Aminosäuren, einschließlich Backbone in einer erweiterten Bestätigung.
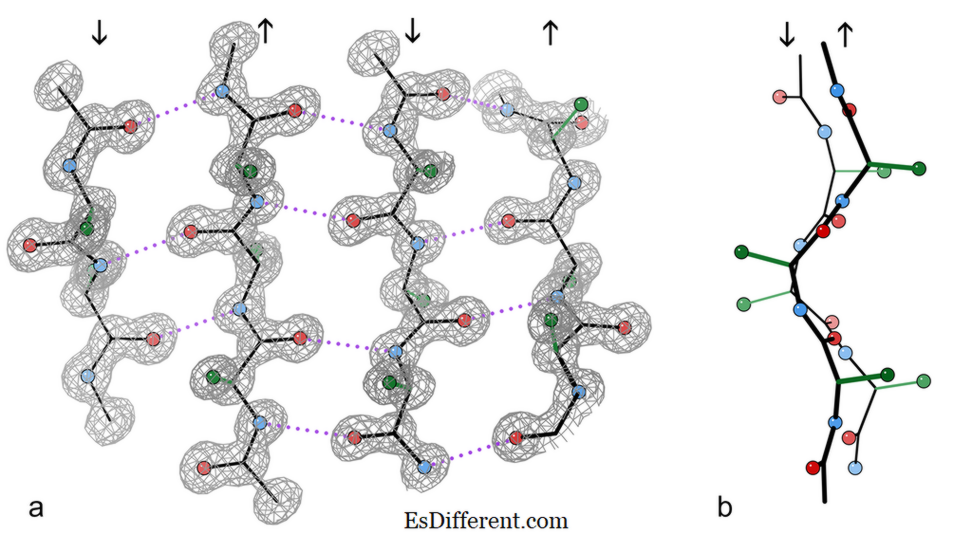
4-strängiges antiparalleles β-Faltblattfragment aus einer Kristallstruktur des Enzyms Catalase.
a) zeigt die antiparallelen Wasserstoffbrücken (punktiert) zwischen Peptid NH- und CO-Gruppen an benachbarten Strängen. Die Pfeile zeigen die Kettenrichtung und die Konturen der Elektronendichte umreißen die Nicht-H-Atome. O-Atome sind rote Kugeln, N-Atome sind blau, und H-Atome sind der Einfachheit halber weggelassen; Seitenketten werden nur an der ersten Seitenkette C-Atom (grün) gezeigt
b) Kantenansicht der zentralen zwei β-Stränge
In beta-gefalteten Blättern verlaufen die Polypeptidketten nebeneinander. Aufgrund der wellenartigen Erscheinung der Struktur erhält sie den Namen "Faltblatt". Sie sind durch Wasserstoffbrücken miteinander verbunden.Diese Struktur ermöglicht die Bildung von mehr Wasserstoffbindungen durch Strecken der Polypeptidkette.
Was ist der Unterschied zwischen Alpha Helix und Beta Pleated Sheet?
Struktur der Alpha-Helix und Beta-Faltblatt
Alpha-Helix:
In dieser Struktur ist das Polypeptid-Rückgrat fest um eine imaginäre Achse als Spiralstruktur gebunden. Es ist auch bekannt als die schraubenförmige Anordnung der Peptidkette.
Die Bildung der Alpha-Helix-Struktur geschieht, wenn die Polypeptidketten zu einer Spirale verdreht werden. Dadurch können alle Aminosäuren in der Kette Wasserstoffbrücken (eine Bindung zwischen einem Sauerstoffmolekül und einem Wasserstoffmolekül) miteinander bilden. Die Wasserstoffbrücken erlauben es der Spirale, die Spiralform zu halten und eine enge Spirale zu erzeugen. Diese Spiralform macht die Alpha Helix sehr stark.
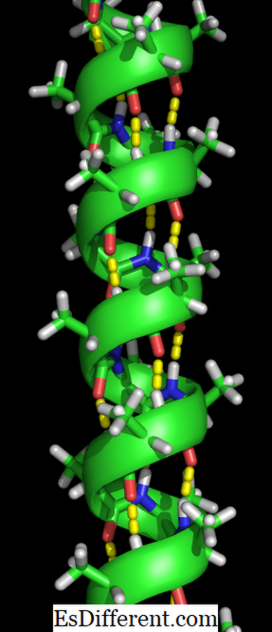
Wasserstoffbrücken sind durch gelbe Punkte gekennzeichnet.
Beta-Faltblatt:
Wenn zwei oder mehr Fragmente der Polypeptidkette (n) miteinander überlappen und eine Reihe von Wasserstoffbrücken miteinander bilden, können folgende Strukturen gefunden werden. Es kann auf zwei Arten geschehen; parallele Anordnung und antiparallele Anordnung.
Beispiele für die Struktur:
Alpha Helix: Fingernägel oder Fußnägel können als Beispiel für eine Alpha-Helix-Struktur verwendet werden.
Beta-Faltblatt: Die Struktur von Federn ähnelt der Struktur von Beta-Faltblatt.
Merkmale der Struktur:
Alpha-Helix: In der Alpha-Helix-Struktur gibt es 3 6 Aminosäuren pro Windung der Helix. Alle Peptidbindungen sind trans- und planar, und die N-H-Gruppen in den Peptidbindungen zeigen in die gleiche Richtung, die in etwa parallel zur Helixachse verläuft. Die C = O-Gruppen aller Peptidbindungen zeigen in die entgegengesetzte Richtung und sind parallel zur Achse der Helix. Die C = O-Gruppe jeder Peptidbindung ist an die N-H-Gruppe der Peptidbindung gebunden, die eine Wasserstoffbrücke bildet. Alle R-Gruppen sind von der Helix nach außen gerichtet.
Beta-Faltblatt: Jede Peptidbindung im Beta-Faltblatt ist planar und hat die Transkonformation. Die C = O- und N-H-Gruppen von Peptidbindungen benachbarter Ketten sind in der gleichen Ebene und zeigen zueinander, wodurch eine Wasserstoffbindung zwischen ihnen entsteht. Alle R-Gruppen in irgendeiner Kette können alternativ oberhalb und unterhalb der Ebene des Blattes auftreten.
Definitionen:
Sekundärstruktur: Es ist die Form eines faltenden Proteins aufgrund von Wasserstoffbrücken zwischen seinen Amid- und Carbonylgruppen.
Referenzen: "Proteinstruktur". ChemWiki: Der dynamische Chemie Hypertext "Protein Sekundärstruktur: α-Helices und β-Sheets". Proteinstrukturen. com von Salam Al Karadaghi "Organische Chemie". Das virtuelle Zell-Lehrbuch "Beta Sheet". Wikipedia Bild mit freundlicher Genehmigung: "Helix electron density myoglobin 2nrl 17-32" Von Dcrjsr - Eigene Arbeit (CC BY 3. 0) via Commons Wikimedia "Protein sekundäre Struktur" von en: Benutzer: Bikadi (CC BY-SA 3. 0) via Commons Wikimedia "1gwe antipar beta Blatt beides" von Dcrjsr - Eigene Arbeit (CC BY 3.0) über Commons Wikimedia


