Unterschied zwischen S- und P-Blockelementen | S vs P Blockelemente
P-Block-Elemente
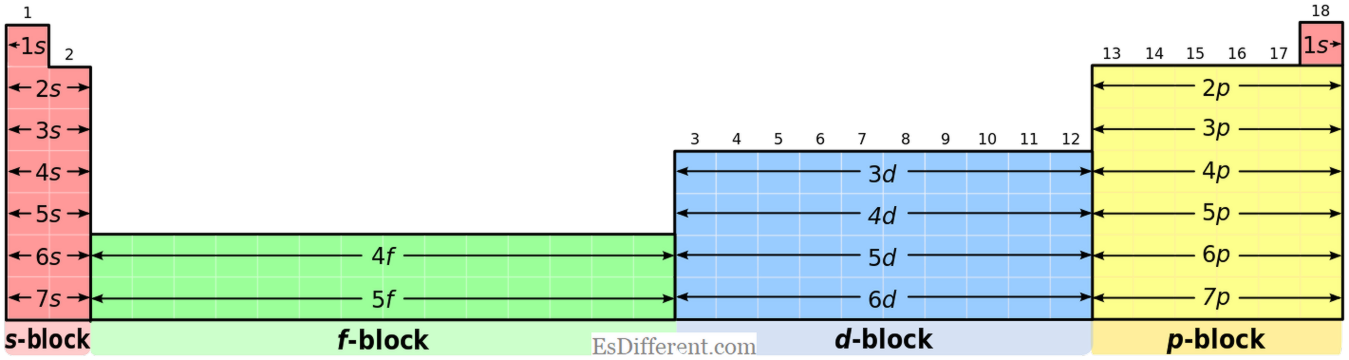
Die -Tastendifferenz zwischen s- und p-Blockelementen lässt sich am besten anhand ihrer elektronischen Konfiguration erklären. In den s-Blockelementen füllt sich das letzte Elektron zur s-Subshell und in p-Blockelementen füllt sich das letzte Elektron zur p-Subshell. Wenn sie Ionen bilden; s-Blockelemente entfernen ihre Elektronen leicht aus der äußersten s-Subshell, während p-Blockelemente Elektronen zur p-Subshell akzeptieren oder Elektronen aus der p-Subshell entfernen. Einige Elemente in der p-Gruppe bilden positive Ionen, die Elektronen aus der äußersten p-Subshell entfernen, und einige Elemente (die elektronegativsten Elemente) bilden negative Ionen, die ein Elektron von anderen annehmen. Wenn Sie die chemischen Eigenschaften berücksichtigen, besteht ein wesentlicher Unterschied zwischen s- und p-Blockelementen. Das ist im Wesentlichen auf die Elektronenkonfiguration zurückzuführen.
Was sind S-Block-Elemente?
S-Block-Elemente sind die chemischen Elemente in Gruppe I und Gruppe II im Periodensystem. Da s Subshell nur zwei Elektronen aufnehmen kann, haben diese Elemente in der äußersten Schale meistens eine (Gruppe I) oder zwei (Gruppe II) Elektronen. Die Elemente in Gruppe I und II sind oben in der Tabelle gezeigt.
- diff Artikel Mitte vor Tabelle ->| IA | II A | |
| 2 | Sr Cs 7 | Fr |
| Ra | Alkalimetalle | II A |
| Erdalkalimetalle | Alle Elemente in s-Block bilden positive Ionen und sind sehr reaktiv. | Die Platzierung der S-Block-Elemente im Periodensystem |
| |
Was sind P-Block-Elemente? | P-Block-Elemente sind die Elemente, deren letztes Elektron in p-Subshell füllt. Es gibt drei p-Orbitale; Jedes Orbital kann zwei Elektronen aufnehmen, was insgesamt sechs p-Elektronen ergibt. Daher haben p-Block-Elemente ein bis sechs p-Elektronen in ihrer äußersten Schale. P-Block enthält sowohl Metalle als auch Nichtmetalle; Außerdem gibt es einige Metalloide. |
| 13 | 14 | 15 |
| 16 | 17 | 18 |
| B | C |
| N | O |
F Ne 3 Al Si P 4 Se
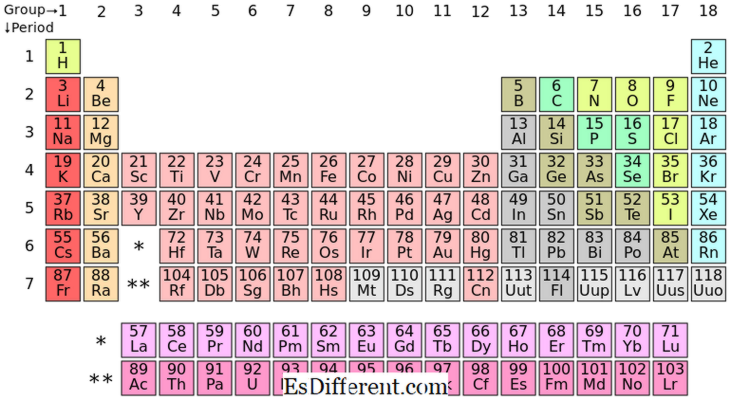
Br
Kr5
In
| Sn | Sb | Te | I | Xe | 6 | |
| Tl | Pb Bi | Po | Bei | Rn | Was ist der Unterschied zwischen S- und P-Blockelementen? | Common Electron Konfiguration: |
| S-block Elemente: | S-Block Elemente haben die gemeinsame Elektronenkonfiguration von [Edelgas] ns | 1 | ] ns | 2 | (für Elemente der Gruppe II). | P-Blockelemente: |
| P-Blockelemente haben die gemeinsame Elektronenkonfiguration von [Edelgas] ns | 2 | np | 1-6 | . Aber Helium hat 1s | 2 | Konfiguration; es ist eine besondere Situation. |
| Oxidationszustände: | S-Block-Elemente: | S-Blockelemente zeigen nicht mehrere Oxidationsstufen wie p-Blockelemente. Zum Beispiel zeigen die Elemente der Gruppe I Oxidationsstufe +1 und Oxidationsstufe II der Gruppe II. | P-Block-Elemente: | Im Gegensatz zu den s-Block-Elementen haben p-block-Elemente eine gemeinsame Oxidationsstufe für ihre jeweilige Gruppe im Periodensystem und einige andere zusätzliche Oxidationsstufen in Abhängigkeit von der Stabilität des Ions. | Gruppe | 13 |
| 14 | 15 | 16 | 17 | 18 | Allgemeine Elektronenkonfiguration | ns |
2
np
1 ns 2 np 2 ns
2 np 3 ns 2 np 4 n9 2
np
5 ns
C N




