Unterschied zwischen 1s und 2s Orbital | 1s vs 2s Orbital
Schlüsselunterschied - 1s vs 2s Orbital
Atom ist die kleinste Einheit der Materie. Mit anderen Worten, die Materie ist aus Atomen zusammengesetzt. Ein Atom besteht aus subatomaren Teilchen, hauptsächlich Protonen, Elektronen und Neutronen. Protonen und Elektronen bilden den Kern, der sich im Zentrum des Atoms befindet. Aber Elektronen sind in Orbitalen (oder Energieniveaus) positioniert, die sich außerhalb des Kerns eines Atoms befinden. Es ist auch wichtig zu beachten, dass Orbitale hypothetische Konzepte sind, die verwendet werden, um den wahrscheinlichsten Ort eines Atoms zu erklären. Es gibt verschiedene Orbitale, die den Kern umgeben. Es gibt auch Suborbitale wie s, p, d, f usw. Das s-Suborbital ist kugelförmig, wenn es als 3D-Struktur betrachtet wird. Das s-Orbital hat die höchste Wahrscheinlichkeit, ein Elektron im Kern zu finden. Ein Unterorbital wird entsprechend den Energieniveaus wieder als 1s, 2s, 3s usw. nummeriert. Der Hauptunterschied zwischen 1s und 2s Orbital ist die Energie jedes Orbitals. 1s-Orbital hat eine niedrigere Energie als das 2s-Orbital.
INHALT
1. Übersicht und Tastendifferenz
2. Was ist 1s Orbital
3. Was ist 2s Orbital
4. Seite an Seite Vergleich - 1s vs 2s Orbital
5. Zusammenfassung
Was ist 1s Orbital?
1s Orbital ist das Orbital, das dem Kern am nächsten ist. Es hat die niedrigste Energie unter anderen Orbitalen. Es ist auch die kleinste sphärische Form. Daher ist der Radius des s-Orbitals klein. Es können nur 2 Elektronen im s-Orbital vorhanden sein. Die Elektronenkonfiguration kann als 1s 1 geschrieben werden, wenn nur ein Elektron im s-Orbital vorhanden ist. Aber wenn es ein Elektronenpaar gibt, kann es als 1s 2 geschrieben werden. Dann bewegen sich die beiden Elektronen im s-Orbital aufgrund der Abstoßung, die aufgrund der gleichen elektrischen Ladungen der beiden Elektronen auftritt, in die entgegengesetzten Richtungen. Wenn es ein ungepaartes Elektron gibt, heißt es paramagnetisch. Das liegt daran, dass es von einem Magneten angezogen werden kann. Wenn aber das Orbital gefüllt ist und ein Elektronenpaar vorhanden ist, können die Elektronen nicht von einem Magneten angezogen werden; das ist als diamagnetisch bekannt.
Was ist 2s Orbital?
Das 2s-Orbital ist größer als 1s Orbital. Daher ist sein Radius größer als der des 1s-Orbitals. Es ist der nächste Schrank Orbital zum Kern nach 1s Orbital. Seine Energie ist höher als 1s Orbital, ist aber niedriger als andere Orbitale in einem Atom. 2s Orbital kann auch nur mit einem oder zwei Elektronen gefüllt werden. Aber das 2s-Orbital ist erst nach Vollendung des 1s-Orbitals mit Elektronen gefüllt.Dies nennt man Aufbauprinzip, das die Reihenfolge der Elektronen in Suborbitale angibt.
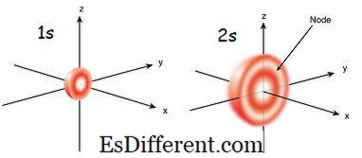
Abbildung 01: 1s und 2s Orbital
Was ist der Unterschied zwischen 1s und 2s Orbital?
- diff Artikel Mitte vor Tabelle ->
1s vs 2s Orbital |
|
| 1s Orbital ist das nächstgelegene Orbital zum Kern. | 2s Orbital ist das zweitnächste Orbital zum Kern. |
| Energieniveau | |
| Die Energie des 1s-Orbitals ist höher als die des 2s-Orbitals. | 2s hat vergleichsweise weniger Energie. |
| Radius des Orbitals | |
| Der Radius des 1s-Orbitals ist kleiner. | Der Radius des 2s-Orbitals ist vergleichsweise groß. |
| Größe des Orbitals | |
| 1s Orbital hat die kleinste sphärische Form. | 2s Orbital ist größer als das 1s Orbital. |
| Elektronenfüllung | |
| Elektronen werden zuerst in das 1s-Orbital gefüllt. | 2s-Orbital ist erst nach Vollendung der Elektronen im 1s-Orbital gefüllt. |
Zusammenfassung - 1s vs 2s Orbital
Ein Atom ist eine 3D-Struktur, die einen Kern im Zentrum enthält, der von unterschiedlich geformten Orbitalen unterschiedlicher Energieniveaus umgeben ist. Diese Orbitale werden nach geringfügigen Energiedifferenzen wieder in Unterorbitale unterteilt. In diesen Energieniveaus befinden sich Elektronen, ein wichtiges subatomares Teilchen eines Atoms. 1s und 2s Suborbitale sind dem Kern am nächsten. Der Hauptunterschied zwischen 1s und 2s Orbitalen ist der Unterschied ihres Energieniveaus, dh 2s Orbital ist ein höheres Energieniveau als 1s Orbital.
Referenz:
1. Libretexts. "Atomische Orbitale. "Chemie LibreTexts. Libretexts, 03. November 2015. Web. 26. Mai 2017..
2. Atome, Elektronen und Orbitale. N. p., n. d. Web. 26. Mai 2017..
Bild mit freundlicher Genehmigung:
1. "S Orbitale" (abgeschnitten) Von CK-12 Foundation - File: High School Chemie. pdf, Seite 265 (CC BY-SA 3. 0) über Commons Wikimedia



