Unterschied zwischen Alkalinität und Basizität | Alkalinität vs Basizität
- Alkalinität vs. Basizität
Die beiden Begriffe "Alkalinität" und "Basizität" sind ziemlich verwirrend. Die meisten Leute wissen, dass es einen Unterschied zwischen diesen beiden Parametern gibt, aber nur wenige von ihnen sind in der Lage, sie korrekt zu definieren. Die Schlüsseldifferenz zwischen diesen beiden Begriffen wird am besten in ihren Definitionen erklärt. Die Basizität ist ein Maß, das direkt von der pH-Skala abhängt und die Alkalinität ist, wie viel Säure erforderlich ist, um den pH-Wert auf einen signifikanten Säurewert zu senken; es ist auch bekannt als Pufferkapazität eines Wasserkörpers . Mit anderen Worten, der pH-Wert von basischen Lösungen variiert von 7-14; wo die Lösungen mit hohen pH-Werten basischer sind. Beide haben mehrere Definitionen, aber die allgemeine Idee ist ähnlich.
Was ist Alkalinität?
Alkalität ist einer der wichtigsten Parameter in aquatischen Körpern, und es ist sehr wichtig für die Wasserorganismen . Alkalinität misst die Fähigkeit von Wasserkörpern, Säuren und Basen zu neutralisieren. Mit anderen Worten ist es die Pufferkapazität eines Wasserkörpers, den pH-Wert auf einem ziemlich stabilen Wert zu halten. Wasser mit einem Gehalt an Bicarbonaten (HCO 3 - ), Carbonaten (CO 3 2-) und Hydroxiden (OH - ; sie können mit H + -Ionen in Wasser kombiniert werden, um den pH-Wert (wird basischer) des Wassers zu erhöhen. Wenn die Alkalinität zu niedrig ist (die Pufferkapazität ist niedrig), senkt jede dem Wasserkörper zugegebene Säure ihren pH-Wert auf einen höheren sauren Wert.
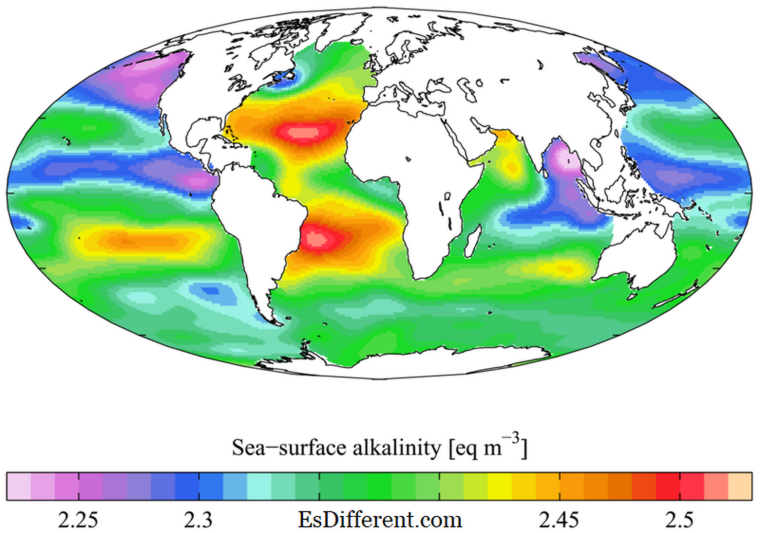
eine Eigenschaft von Basen, gemessen in der pH-Skala . Basen sind die Verbindungen, die einen pH von mehr als 7 enthalten; von pH = 8 (weniger basisch) bis pH = 18 (basischer). Die Basizität einer Verbindung kann auf drei verschiedene Arten definiert werden. Gemäß der Arrhenius-Theorie sind Basen die Substanzen, die in wässrigem Medium dissoziieren und OH - -Ionen erzeugen. In der Bronsted-Lowry-Theorie werden Protonenakzeptoren als Basen bezeichnet. Gemäß der Lewis-Theorie wird ein Elektronenpaar-Donor Base genannt. Die Basizität ist die Ionisation der Stärke, um OH - -Ionen zu erzeugen, die Fähigkeit, Protonen aufzunehmen oder Elektronen zu spenden.

Was ist der Unterschied zwischen Alkalinität und Basizität?
Definition von Alkalinität und Basizität:
Alkalinität:
Mehrere Definitionen sind vorhanden. Alkalinität ist die Säureneutralisierungskapazität von gelösten Stoffen in einer Wasserprobe, gemessen in Milliäquivalenten pro Liter.
Die Summe von titrierbaren Carbonat- und Nichtkarbonat-chemischen Spezies in einer gefilterten Wasserprobe.
Die Fähigkeit von Wasser, eine Säurelösung zu neutralisieren.
Die Pufferkapazität von Wasser, um einen relativ stabilen pH-Wert beizubehalten, ohne den pH-Wert zu verändern, wenn Säure zugesetzt wird.
Basizität:
Drei Theorien werden verwendet, um Säure und Basizität zu definieren. Arrenhius:
Basen sind die Spezies, die ionisieren, um OH - in Wasser zu erzeugen. Die Basizität erhöht sich, wenn sie mehr ionisieren, was OH - in Wasser ergibt. Bronsted-Lowry:
Protonen (H + ) Akzeptoren werden Basen genannt. Lewis:
Elektronenpaardonoren werden als Basen bezeichnet. Faktoren, die die Alkalinität und die Basizität beeinflussen:
Alkalinität:
Die Alkalinität hängt nicht vom pH-Wert ab; Wasserkörper können entweder einen niedrigeren (stark sauren) oder einen höheren (basischen) pH-Wert mit einem höheren Wert für die Alkalinität aufweisen. Die Alkalität wird durch verschiedene Faktoren wie Gesteine, Boden, Salze und bestimmte industrielle Aktivitäten (Abwässer, die Seife und Reinigungsmittel enthalten, vom Menschen alkalisch) bestimmt. Zum Beispiel können die Bereiche, in denen Kalkstein (CaCO 3 ) signifikant verfügbar ist, mehr alkalisches Wasser haben. Basizität:
Faktoren, die die Basizität einer Verbindung beeinflussen, hängen von der Definition der Basizität ab. Zum Beispiel hängt die Elektronenpaarverfügbarkeit einer Base von drei Faktoren ab. Elektronegativität
: CH3-> NH2-> HO-> F- Bei Betrachtung der Atome in derselben Reihe im Periodensystem hat das elektronegativste Atom die höhere Basizität.
Größe
: F-> Cl-> Br-> I- Wenn man eine Reihe des Periodensystems betrachtet, hat das Atom die geringere Elektronendichte und ist weniger basisch.
Resonanz
: RO-> RCO 2- Moleküle mit mehr Resonanzstrukturen sind weniger basisch, da die Elektronen weniger verfügbar sind als eine lokalisierte negative Ladung.
Bild mit freundlicher Genehmigung:
1. "WOA05 GLODAP pd ALK AYool" von Plumbago - Eigene Arbeit. [CC BY-SA 3. 0] über Commons
2. "Thomas Martin Lowry2" von Anonymous - Nachruf von der Faraday Soc. (1936). [Gemeinfreiheit] via Commons




