Unterschied zwischen Hydroxyl und Hydroxid | Hydroxyl vs Hydroxid
Schlüsselunterschied - Hydroxyl vs Hydroxid
Die beiden Begriffe Hydroxyl und Hydroxid klingen sehr ähnlich, da beide zwei ähnliche Atome haben: Sauerstoff (O = H = 1). Hydroxid ist ein negatives Ion mit einer einzigen Ladung und Hydroxyl wird nicht in seiner freien Form gefunden, es ist ein Teil eines anderen Moleküls oder eines anderen Ion. Hydroxidionen sind reaktiver als die Hydroxylgruppe in einem Molekül. Dies ist der Hauptunterschied zwischen Hydroxyl und Hydroxid.
Was ist Hydroxyl?
Hydroxyl ist eine neutrale Verbindung und es ist die entsprechende elektrisch neutrale Verbindung eines Hydroxidions. Die freie Form von Hydroxyl (• HO) ist ein Radikal, und wenn es kovalent an andere Moleküle gebunden ist, wird es als Hydroxylgruppe (-OH) bezeichnet. Hydroxylgruppen können als Nucleophile wirken und Hydroxylradikale werden als Katalysator in der organischen Chemie verwendet. Hydroxylgruppen sind nicht hochreaktiv wie die anderen Nucleophile. Sie sind jedoch die Vermittler bei der Bildung von starken intramolekularen Kräften, die als "Wasserstoffbrücken" bezeichnet werden.

Was ist Hydroxid?
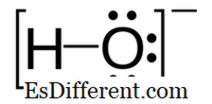
Hydroxid ist ein zweiatomiges Anion, das ein Sauerstoffatom und ein Wasserstoffatom enthält. Die Bindung zwischen Sauerstoff und Wasserstoffatom ist kovalent und die chemische Formel ist OH - . Die Selbstionisation von Wasser erzeugt Hydroxylionen und daher sind Hydroxylionen ein natürlicher Teil im Wasser. Hydroxidionen werden als Base, Ligand, Nukleophil und Katalysator in chemischen Reaktionen eingesetzt. Außerdem erzeugen Wasserstoffionen Salze mit Metallkationen, und die meisten von ihnen dissoziieren in wässrigen Lösungen unter Freisetzung von solvatisierten Hydroxidionen. Viele anorganische chemische Substanzen enthalten in ihrem Namen den Begriff "Hydroxid", aber sie sind nicht ionisch und sie sind kovalente Verbindungen, die Hydroxylgruppen enthalten.

Was ist der Unterschied zwischen Hydroxyl und Hydroxid?
Struktur:
Hydroxyl: Hydroxyl ist eine elektrisch neutrale Verbindung, die als Radikal- und als kovalent gebundene Form zwei Wege findet.

Hydroxylradikal Wenn es kovalent an ein Molekül gebunden ist
Hydroxid: Hydroxid ist ein negativ geladenes Ion und die negative Ladung befindet sich am Sauerstoffatom.
Hydroxyl: Hydroxylgruppen werden in vielen organischen Verbindungen gefunden; Alkohole, Carbonsäuren und Hydroxylgruppen, die Zucker enthalten. Hydroxylgruppen enthaltende Verbindungen wie Wasser, Alkohole und Carbonsäuren können leicht deprotoniert werden.Außerdem sind diese Hydroxylgruppen an der Bildung von Wasserstoffbrücken beteiligt. Wasserstoffbrücken helfen, dass Moleküle zusammenkleben und dies führt zu höheren Siede- und Schmelzpunkten. Im Allgemeinen sind organische Verbindungen schlecht wasserlöslich; diese Moleküle werden leicht wasserlöslich, wenn sie zwei oder mehr Hydroxylgruppen enthalten.
Hydroxid: Die meisten Chemikalien, die Hydroxid enthalten, gelten als sehr ätzend und einige sind sehr schädlich. Wenn diese Chemikalien in Wasser gelöst werden, wirkt das Hydroxid-Ion als eine unglaublich starke Base. Da das Hydroxid-Ion eine negative Ladung trägt, ist es oft an positiv geladene Ionen gebunden.
Einige ionische Verbindungen, die Hydroxidgruppen in ihrem Molekül enthalten, lösen sich in Wasser sehr gut auf; korrosive Basen wie Natriumhydroxid (NaOH) und Kaliumhydroxid (KOH) können als Beispiele genommen werden. Einige andere Hydroxid enthaltende ionische Verbindungen sind jedoch in Wasser leicht unlöslich; Beispiele sind Kupfer (II) -hydroxid [Cu (OH) 2 - hellblau gefärbt] und Eisen (II) -hydroxid [Fe (OH) 2 - braun].
Reaktivität:
Hydroxyl : Hydroxylgruppen sind im Vergleich zur Hydroxidgruppe weniger reaktiv. Hydroxylgruppen bilden jedoch leicht Wasserstoffbrücken und tragen dazu bei, Moleküle in Wasser löslicher zu machen.
Hydroxylradikale sind jedoch sehr reaktiv und in organisch-chemischen Reaktionen sehr nützlich.
Hydroxid: Hydroxid (OH - ) wird als starkes Nucleophil in der organischen Chemie angesehen.
Referenzen: Martin. Chaplin @ btinternet. com, M. C. (n. d.). Hydroxidionen. Abgerufen 28. Dezember 2016 von hierHydroxide Ion: Definition & Formel - Video & Lektion Transkript. (n. d.). Abgerufen 28. Dezember 2016, von hierHydroxid. (n. d.). Abgerufen 28. Dezember 2016 von hierHydroxy-Gruppe. (n. d.). Abgerufen 28. Dezember 2016 von hierHydroxyl Group: Definition, Struktur & Formel. (n. d.). Abgerufen 28. Dezember 2016, von hier aus H. (2014). Was ist eine Hydroxylgruppe? Von 28. Dezember 2016, von hier



