Unterschied zwischen Alkalimetallen und Erdalkalimetallen | Alkalimetalle vs Erdalkalimetalle
Alkalimetalle vs Erdalkalimetalle < Da sowohl Alkalimetalle als auch Erdalkalimetalle die ersten beiden Gruppen im Periodensystem sind, ist der Unterschied zwischen Alkalimetallen und Erdalkalimetallen für jeden Chemiestudenten von Interesse. Alkalimetalle und Erdalkalimetalle werden auch als "S-Block" -Elemente bezeichnet, da Elemente in diesen beiden Gruppen das / die äußerste (n) Elektron (e) in der s-Subshell haben.
Im Allgemeinen verwendeten wir das Wort "Metall" für die Materialien, die Elektrizität leiten; Sowohl Alkalimetalle als auch Erdalkalimetalle sind gute elektrische und Wärmeleiter. Die Elemente in diesen beiden Gruppen sind die reaktivsten Metalle im Periodensystem. Ihre Schmelzpunkte sind im Vergleich zu anderen Metallen relativ niedrig. Alkalimetalle und Erdalkalimetalle haben viele ähnliche Eigenschaften, aber dieser Artikel diskutiert hauptsächlich ihre Unterschiede.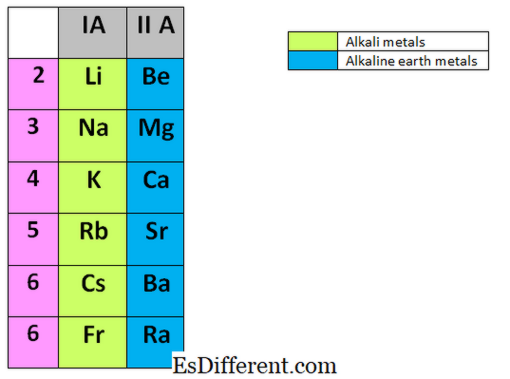
Die Alkalimetalle sind die Elemente in der ersten Gruppe des Periodensystems. Sie sind Lithium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Cäsium (Cs) und Francium (Fr). Sie sind alle Metalle und sehr reaktiv, und keines dieser Metalle kommt in der Natur nicht als freies Metall vor. Alkalimetalle werden immer in inerten Flüssigkeiten wie Kerosin gelagert, da sie schnell mit Luft, Wasserdampf und Sauerstoff in der Luft reagieren. Manchmal reagieren sie explosiv mit anderen Substanzen. Sie können den Zustand des Edelgases leicht erreichen, indem sie das äußerste Elektron in der Valenzschale entfernen.
Die Dichten von Lithium und Natrium sind geringer als die Dichte von Wasser. Die anderen Elemente sind jedoch dichter als Wasser. Viele Alkalimetallverbindungen (NaCl, KCl, Na 2 CO 3, NaOH) sind kommerziell sehr wichtig. Was sind Erdalkalimetalle?
Erdalkalimetalle finden sich in der zweiten Gruppe des Periodensystems. Elemente der Gruppe II umfassen: Beryllium (Be), Magnesium (Mg), Calcium (Ca), Strontium (Sr), Barium (Ba) und Radium (Ra). Ähnlich wie bei Alkalimetallen kommen diese Elemente auch nicht frei in der Natur vor und sind auch sehr reaktiv.
Alle Elemente in dieser Gruppe sind dichter als Wasser. Reine Metalle sind silbergrau gefärbt, neigen jedoch schnell zur Entfärbung, wenn sie der Luft ausgesetzt werden, weil sie eine Oxidschicht auf der Oberfläche bilden. Diese Metalle sind ebenso wie Alkalimetalle gute Wärmeleiter und Stromleiter.Alle Erdalkalimetalle sind kommerziell wertvoll.
Was ist der Unterschied zwischen Alkalimetallen und Erdalkalimetallen?
Elektronenkonfiguration
- Alkalimetalle haben die elektronische Konfiguration von [Edelgas] ns 1 und Erdalkalimetalle haben [Edelgas] ns 2 elektronische Konfiguration. Valenz
- : Alle Alkalimetalle haben ein Elektron in ihrer äußersten Schale und alle Erdalkalimetalle haben zwei äußere Elektronen. Um die Edelgaskonfiguration zu erreichen, müssen Alkalimetalle ein Elektron verlieren (Valenz ist "eins"), während Erdalkalimetalle zwei Elektronen entfernen müssen (Valenz ist "zwei"). Reaktivität
- : Sowohl Alkalimetalle als auch Alkalimetalle sind sehr reaktiv. Alkalimetalle sind reaktiver als Erdalkalimetalle. Ionische Ladung
- : Alkalimetalle haben eine ionische Ladung von +1 in ihren Verbindungen und Erdalkalimetalle haben eine +2 ionische Ladung in den Verbindungen. Härte
- : Alkalimetalle sind sehr weich und können mit einem scharfen Messer geschnitten werden. Erdalkalimetalle sind härter als die Alkalimetalle. Zusammenfassung:
Alkalimetalle vs Erdalkalimetalle