Unterschied zwischen ionischen und kovalenten Verbindungen | Ionische gegenüber kovalenten Verbindungen
Unterschiedliche Unterschiede zwischen ionischen und kovalenten Verbindungen aufgrund ihrer makroskopischen Eigenschaften wie Löslichkeit in Wasser, elektrische Leitfähigkeit, Schmelzpunkte und Siedepunkte. Der Hauptgrund für diese Unterschiede ist der Unterschied in ihrem Bindungsmuster. Daher kann ihr
-Bindungsmuster als Hauptunterschied zwischen ionischen und kovalenten Verbindungen angesehen werden. (Unterschied zwischen ionischen und kovalenten Bindungen) Wenn ionische Bindungen gebildet werden, wird Elektron (e) von einem Metall gespendet und gespendetes Elektron wird von einem Nichtmetall akzeptiert. Sie bilden aufgrund der elektrostatischen Anziehung eine starke Bindung. Kovalente Bindungen werden zwischen zwei Nichtmetallen gebildet. Bei der kovalenten Bindung teilen zwei oder mehr Atome Elektronen, um die Oktettregel zu erfüllen. Im Allgemeinen sind ionische Bindungen stärker als kovalente Bindungen. Dies führt zu den Unterschieden in ihren physikalischen Eigenschaften.
Was sind ionische Verbindungen?Ionische Bindungen entstehen, wenn zwei Atome einen großen Unterschied in ihren Elektronegativitätswerten haben. Im Prozess der Bindungsbildung gewinnen die weniger elektronegativen Atomverluste Elektron (en) und mehr elektronegative Atome diese Elektronen (s). Daraus resultierende Spezies sind entgegengesetzt geladene Ionen und bilden aufgrund der starken elektrostatischen Anziehung eine Bindung.
Beispiel einer ionischen Verbindung
ist Na + + Cl - NaCl Natrium hat nur ein Valenzelektron und Chlor (Nichtmetall) sieben Valenzelektronen.

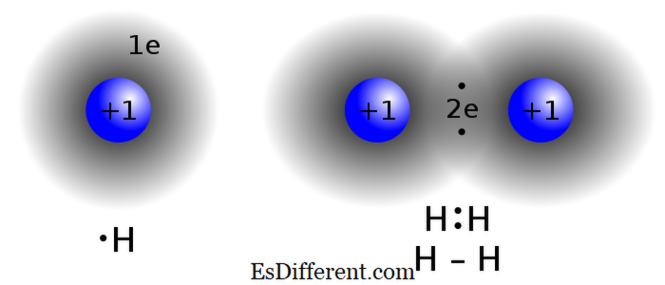
Kovalente Verbindungen werden gebildet, indem Elektronen zwischen zwei oder mehr Atomen geteilt werden, um die "Oktett-Regel" zu erfüllen. Dieser Bindungstyp wird üblicherweise in Nichtmetallverbindungen, Atomen der gleichen Verbindung oder in der Nähe befindlichen Elementen des Periodensystems gefunden. Zwei Atome mit annähernd gleichen Elektronegativitätswerten tauschen keine Elektronen aus ihrer Valenzschale aus (donate / receive). Stattdessen teilen sie Elektronen, um eine Oktett-Konfiguration zu erzielen.
Beispiele für kovalente Verbindungen
sind Methan (CH 4 ), Kohlenmonoxid (CO), Iodmonobromid (IBr) Kovalente Bindung
Was ist der Unterschied zwischen ionischen und kovalenten Verbindungen?
Definition von ionischen Verbindungen und kovalenten Verbindungen
Ionische Verbindung:
Ionische Verbindung ist eine chemische Verbindung von Kationen und Anionen, die durch ionische Bindungen in einer Gitterstruktur zusammengehalten werden. Kovalente Verbindung:
Kovalente Verbindung ist eine chemische Bindung, die durch die gemeinsame Nutzung eines oder mehrerer Elektronen, insbesondere Elektronenpaare, zwischen Atomen gebildet wird. Eigenschaften von ionischen und kovalenten Verbindungen
Physikalische Eigenschaften
Ionische Verbindungen:
Alle ionischen Verbindungen liegen bei Raumtemperatur als Feststoffe vor.
Ionische Verbindungen haben eine stabile Kristallstruktur. Sie haben daher höhere Schmelzpunkte und Siedepunkte. Die Anziehungskräfte zwischen positiven und negativen Ionen sind sehr stark.
- diff Artikel Mitte vor Tabelle ->
Ionische Verbindung| Aussehen | Schmelzpunkt | NaCl - Natriumchlorid |
| Weißer kristalliner Feststoff | 801 ° C | KCl - Kaliumchlorid |
| Weißer oder farbloser glasartiger Kristall | 770 ° C | MgCl |
| 2 Magnesiumchlorid Weißer oder farbloser kristalliner Feststoff | 1412 ° C | Kovalente Verbindungen: Kovalente Verbindungen existieren in allen drei Formen; als Feststoffe, Flüssigkeiten und Gase bei Raumtemperatur. |
Ihre Schmelz- und Siedepunkte sind im Vergleich zu den ionischen Verbindungen relativ niedrig.
Kovalente Verbindung
Aussehen
| Schmelzpunkt | HCl-Chlorwasserstoff | Ein farbloses Gas |
| -114. Ein farbloses Gas | -182 ° C | CCl |
| 4 Tetrachlorkohlenstoff Eine farblose Flüssigkeit < -23 ° C | Leitfähigkeit | Ionische Verbindungen: |
| Feste ionische Verbindungen haben keine freien Elektronen; Sie leiten daher keinen Strom in fester Form. Aber wenn ionische Verbindungen in Wasser gelöst werden, bilden sie eine Lösung, die Elektrizität leitet. Mit anderen Worten sind wässrige Lösungen von ionischen Verbindungen gute elektrische Leiter. Kovalente Verbindungen: Weder reine kovalente Verbindungen noch gelöste Formen in Wasser leiten keinen Strom. Daher sind kovalente Verbindungen in allen Phasen schlechte elektrische Leiter. | Löslichkeit | Ionische Verbindungen: |
Die meisten ionischen Verbindungen sind in Wasser löslich, aber in unpolaren Lösungsmitteln unlöslich.
Kovalente Verbindungen: Die meisten der kovalenten Verbindungen sind in unpolaren Lösungsmitteln löslich, jedoch nicht in Wasser.
Härte Ionische Verbindungen:
Ionische Feststoffe sind härtere und spröde Verbindungen.
Kovalente Verbindungen: Im Allgemeinen sind kovalente Verbindungen weicher als ionische Feststoffe.
Bild mit freundlicher Genehmigung: "Covalent bond hydrogen" von Jacek FH - Eigene Arbeit. (CC BY-SA 3. 0) via Commons "IonicBondingRH11" von Rhannosh - Eigene Arbeit. (CC BY-SA 3. 0) über Wikimedia Commons




