Unterschied zwischen Nitrat und Nitrit
Nitrate gegen Nitrit
Sowohl Nitrat als auch Nitrit sind Oxyanionen von Stickstoff. Obwohl sie beide gleich aussehen, gibt es Unterschiede zwischen ihnen. Diese Unterschiede können in Bezug auf ihre Struktur, Bindung, geometrische Form, Oxidationsstufe von Stickstoff, chemische Reaktivität, Verwendungen von ihnen usw. sein. Diese Unterschiede werden hauptsächlich hier diskutiert.
- 999 -> NO3 - Ion ist die konjugierte Base von HNO 3 (Salpetersäure V), die eine starke Säure ist. Es ist ein planares Molekül mit sp 3 Hybridisierung im Stickstoffatom. Alle drei Sauerstoffatome sind gleichwertig. Es gibt 24 Elektronen in den Valenzschalen. NO 3 - Ion hat das Molekulargewicht von 62. 004 g mol -1 . NO
2 - Ion ist die konjugierte Base von HNO 2 (Salpetersäure III), die eine schwache Säure ist (pKa = 3.5). Es ist auch ein planares Molekül mit sp 2 Hybridisierung. In den Valenzschalen gibt es nur 18 Elektronen. NO 2 - Ion hat das Molekulargewicht von 46. 006 g mol -1 . Wenn die Bindung in beiden Ionen betrachtet wird, umfasst die pi-Bindung bei NO
3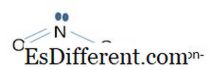

- Ionen vier 2p z Atomorbitale Orbitla aus N und drei Orbitalen aus 3 Sauerstoffatomen). Diese vier Atomorbitale bilden 4, vier-zentrierte pi-Molekülorbitale. Das Molekülorbital mit der niedrigsten Energie ist das Bindungsorbital. Das Orbital mit der größten Energie ist das Anti-Bindungs-Orbital. Andere zwei Orbitale sind degeneriert (gleich in der Energie), die nichtbindende Orbitale sind. Im Fall eines NO 2 - -Ions beinhaltet die pi-Bindung nur drei 2p z Atomorbitale. Hier ist das Orbital mit der niedrigsten Energie das Bindungsorbital, das mittlere ist das nichtbindende Orbitale und das andere ist das Anti-Bindungs-Orbital. In beiden Ionen sind die Bindungsorbitale beteiligt, um die σ-Bindung (Sigma-Bindung) und die nichtbindenden Orbitale bei der Herstellung von π-Bindungen (pi-Bindungen) zu berücksichtigen. Daher hat jede Bindung in NO 3 - eine Bindungsordnung von 1 1 / 3 . 1 aus der σ-Bindung und 1 / 3 aus den π-Bindungen. Die Bindungsordnung beträgt bei NO 2 - 1 1 / 2 . 1 aus der σ-Bindung und 1 / 2 aus den π-Bindungen.
-Ion hat eine dreieckige Form und das NO 2 - . Die Bindungswinkel sind auch unterschiedlich. ONO-Bindungswinkel von NO 3 - und NO 2 - sind jeweils 120 0 bzw. 115 0 . Die Oxidationsstufe von Stickstoff in NO 3 - und NO 2 - beträgt +5 bzw. +3.Aufgrund dieser Gründe (insbesondere des Unterschieds in der Bindung) ist auch die chemische Reaktivität (wie Basizität, Oxidations- / Reduktionsfähigkeit, Produkte der thermischen Zersetzung der Verbindungen aus diesen Ionen) unterschiedlich. In der Praxis ist NO 2 - Ion eine schwächere Base, während NO 3 -
eine sehr schwache Base ist. Wenn der Oxidationszustand des Stickstoffatoms in diesen Ionen berücksichtigt wird, kann NO 2 - Ion sowohl als Reduktionsmittel als auch als Oxidationsmittel wirken, während NO 3 - Ion kann nur als Oxidationsmittel wirken. Die Beispiele für Produkte, die bei der thermischen Zersetzung von NO 3 - und NO 2

Selbst wenn sie Komplexe mit Metallionen bilden, verhalten sie sich auf unterschiedliche Weise. Das heißt, NO 2 - wirkt als einzähniger Ligand, während NO 3 - als zweizähniger Ligand wirkt. Diese Unterschiede in der chemischen Reaktivität helfen uns, ihre Verwendung zu differenzieren. Zum Beispiel werden Nitrite im Allgemeinen bei der Verarbeitung von Fleisch verwendet (manchmal werden auch Nitrate verwendet) und Nitrate werden zur Herstellung von Sprengstoffen verwendet. Nitrate sind natürlich vorkommend und sind krebsartig. Aber Nitrite sind nicht krebsartig.





