Unterschied zwischen Ammoniumnitrat und Harnstoff
Ammoniumnitrat vs Harnstoff
Stickstoffhaltige Verbindungen werden üblicherweise als Düngemittel eingesetzt, da Stickstoff eines der wichtigsten Elemente für Pflanzenwachstum und -entwicklung. Ammoniumnitrat und Harnstoff sind solche stickstoffhaltige Feststoffe.
Ammoniumnitrat
Ammoniumnitrat hat die chemische Formel NH 4 NO 3 . Dies ist das Nitrat von Ammoniak, und es hat die folgende Struktur.

Ammoniumnitrat liegt bei Raumtemperatur und Normaldruck als geruchloser, weißer kristalliner Feststoff vor. Dies ist ein saures Salz mit einem pH-Wert von etwa 5. 4. Seine Molmasse beträgt 80,02 g / mol. Der Schmelzpunkt von Ammoniumnitrat beträgt etwa 170 ° C und zersetzt sich bei Erhitzen auf etwa 210 ° C bis 999 ° C. Ammoniumnitrat wird hauptsächlich für landwirtschaftliche Zwecke verwendet. Es ist reich an Stickstoff und wird daher als Dünger eingesetzt, um Pflanzen Stickstoff zuzuführen. Da der direkte Kontakt mit der Chemikalie nicht gefährlich ist und die Toxizität weniger ist, ist es vorteilhaft, als Dünger zu verwenden. Durch Erhitzen oder Entzünden kann Ammoniumnitrat explodieren. Daher wird es als Oxidationsmittel in Sprengstoffen verwendet. Aufgrund dieser explosiven Natur sollten wir bei der Lagerung von Ammoniumnitrat besonders vorsichtig sein. Ammoniumnitrat ist stabil, aber wenn es im geschmolzenen Zustand ist, ist das Explosionsrisiko höher. Bei Kontakt mit oxidierbaren Materialien wie Öl, Diesel, Papier, Lappen oder Stroh erhöht sich das Risiko. Die Produktion von Ammoniumnitrat ist eine einfache chemische Reaktion. Wenn Salpetersäure mit Ammoniakflüssigkeit umgesetzt wird, wird Ammoniumnitrat in der Lösungsform erzeugt. Industriell werden konzentrierte Salpetersäure und Ammoniakgas zur Herstellung verwendet. Da dies eine stark exotherme und heftige Reaktion ist, ist es schwierig, sie in großem Maßstab herzustellen. Als Salz ist Ammoniumnitrat in Wasser sehr gut löslich. Daher kann es, wenn es als Dünger verwendet wird, abgewaschen und in Gewässern akkumuliert werden. Dies könnte eine tödliche Bedingung für das Leben im Wasser sein. Harnstoff hat die Summenformel von CO (NH 2
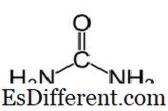
)2
und die folgende Struktur. Es ist ein Carbamid mit der funktionellen Gruppe C = O. Zwei NH 2 -Gruppen sind von zwei Seiten an den Carbonylkohlenstoff gebunden. Harnstoff wird in Säugetieren natürlicherweise im Stickstoff-Stoffwechsel produziert. Dies ist bekannt als der Harnstoffkreislauf, und die Oxidation von Ammoniak oder Aminosäuren produziert Harnstoff in unserem Körper. Der größte Teil des Harnstoffs wird über die Nieren mit Urin ausgeschieden, während einige mit Schweiß ausgeschieden werden. Die hohe Wasserlöslichkeit von Harnstoff ist hilfreich beim Ausscheiden aus dem Körper. Harnstoff ist ein farbloser, geruchloser Feststoff und ist nicht toxisch. Neben der Verwendung als Stoffwechselprodukt wird hauptsächlich Dünger hergestellt.Harnstoff ist einer der häufigsten Stickstoff freisetzenden Düngemittel und hat einen hohen Stickstoffgehalt im Vergleich zu anderen festen stickstoffhaltigen Düngemitteln. Im Boden wird Harnstoff in Ammoniak und Kohlendioxid umgewandelt. Dieses Ammoniak kann durch Bodenbakterien in Nitrit umgewandelt werden. Außerdem wird Harnstoff zur Herstellung von Sprengstoffen wie Harnstoffnitrat verwendet. Es dient auch als Rohstoff zur Herstellung von Chemikalien wie Kunststoffen und Klebstoffen.
Was ist der Unterschied zwischen Ammoniumnitrat und Harnstoff ?
• Die Summenformel von Ammoniumnitrat ist NH



